Forschungs- und Innovationsprojekt
Laufkäfer im Weinberg

Die Carabidenfauna unterschiedlich bewirtschafteter Weinbergsflächen im fränkischen Weinbaugebiet
Eine Begrünung im Weinberg kann die Biodiversität und damit die Artenvielfalt der dort lebenden Nützlinge fördern und zu einer deutlichen Reduktion der Schädlinge führen. Ob eine ganzjährige Begrünung auch in niederschlagsarmen Weinbaugebieten mit weniger als 600 mm Niederschlägen im Jahresmittel zu einer Förderung der Nutzorganismen führt, untersuchte die vorliegende Arbeit.
Ziel des Projektes
Methode des Projektes
Teilzeit- und Dauerbegrünung

Die dauerbegrünte Fläche an Standort I war mit einer Magerrasen-Mischung bewachsen, in der von den ursprünglich vier eingesäten Grasarten (Festuca rubra, Festuca ovina duriuscula, Poa pratensis, Agrostis tenuis) die beiden Schwingelarten etwas in den Vordergrund getreten waren. Standort II zeichnete sich durch eine vielfältig blühende Dauerbegrünung mit einer artenreichen Leguminosen-Kräuter-Mischung aus. Beide dauerbegrünten Flächen befanden sich im dritten Standjahr.
Carabiden - Datenerhebung
Ökologische Kenngrößen der einzelnen Laufkäferarten
- Licht
- euryphot (ep): ohne erkennbare Ansprüche
- photophil (p): bevorzugen offene, sonnige Stellen
- ombrophil (o): bevorzugen schattige Stellen
- Temperatur
- eurytherm (et): keine erkennbaren Ansprüche
- thermophil (t): ausgesprochen wärmeliebend
- oligotherm (ot): bevorzugen niedrige Temperaturen
- Feuchte
- euryhygr (eh): ohne erkennbare Präferenz
- xerophil (x): bevorzugen Trockenstandorte
- hygrophil (h): bevorzugen feuchte Habitate
Ökotypen
- F= Feldarten, die als typische Kulturfolger angesprochen werden können und häufig Charakterarten von Ackerzönosen darstellen.
- H= hygrophile Arten, die auf moorigen Flächen, an feuchten Ufern oder auf Feuchtwiesen vorkommen.
- R= Arten, die Ruderalflächen bevorzugt besiedeln; im Wesentlichen flugfähige Pionierarten.
- T= Arten, die an natürlichen Trockenstandorten wie Trockenrasen, Kalktriften, Wärmehänge und Dünen dominieren.
- W= waldbewohnende Arten.
Phänologische Typen
- Frühjahrsbrüter (F), die im Frühjahr bis Frühsommer auftreten
- Herbstbrüter (H), die im Sommer und Herbst zu finden sind
- eine Gruppe von Arten, die zu den Frühjahrsbrütern gehören, aber zusätzlich einen Herbstbestand aufweisen (F+)
Größenklassen
Körperlänge
- 1: bis 3 mm
- 2: 3,5 - 6 mm
- 3: 6,5 - 10 mm
- 4: 10,5 - 20 mm
- 5: 20,5 - 30 mm
- 6: > 30 mm
Flugvermögen
Ergebnisse
 Zoombild vorhanden
Zoombild vorhanden
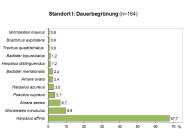
Abb 1 - Standort I
Dies drückt sich auch in einem signifikant höheren Diversitätsindex (nach Shannon/Weaver) von Hs=2.52 am Standort II im Vergleich zum Standort I mit Hs=1.90 (t=7.1, df=404, p<0.001) aus.
 Zoombild vorhanden
Zoombild vorhanden
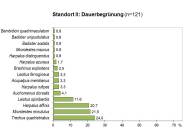
Abb 2 - Standort II
Das Artenspektrum der beiden Standorte wies dennoch eine recht hohe Übereinstimmung mit einem Sörensenindex von Qs=69% auf. Die Reihenfolge der dominanten Arten zeigte dagegen eine weit geringere Übereinstimmung: der Renkonenindex betrug RE=48%.
| Standort I | Standort II | ||
|---|---|---|---|
| Teilzeit-Begrünung | Artenzahl | 27 | 20 |
| Individuenzahl | 617 | 116 | |
| Dauer-Begrünung | Artenzahl | 12 | 15 |
| Individuenzahl | 164 | 121 | |
| Gesamt | Artenzahl | 28 | 24 |
| Individuenzahl | 781 | 237 |
| Standort I | Standort II | |
|---|---|---|
| teilzeitbegrünt | 1,94 | 2,65 |
| dauerbegrünt | 1,25 | 2,08 |
Berücksichtigt man die Verteilung der Individuen auf die einzelnen Arten, so wird der Unterschied zwischen den unterschiedlich bewirtschafteten Flächen noch deutlicher.
 Zoombild vorhanden
Zoombild vorhanden
Abb 3 - Dominanzartenkurve TZ
 Zoombild vorhanden
Zoombild vorhanden
Abb 4 - Dominanzartenkurve DG
Die Evenness liegt für beide Bewirtschaftungsformen mit E=0.59 (TZ) und E=0.50 (DG) ähnlich niedrig.
Die Artenübereinstimmung liegt bei beiden Untersuchungsflächen am Standort I mit einem Sörensenindex von Qs=56% im mittleren Bereich. In der Artenfolge (=Dominanzidentität) besteht zwischen den Arten der beiden Flächen nur eine geringe Übereinstimmung von RE=29%.
In beiden Flächen dominierten xerophile Arten, also Arten, die ausgesprochen trockene Habitate bevorzugen. Der Anteil war auf beiden Fläche ähnlich hoch (TZ: 73%, DG: 75%). Bei 50% der Arten der dauerbegrünten und 46% der teilzeitbegrünten Fläche handelte es sich um weitverbreitete Charakterarten von Agrozönosen und Ruderalflächen mit hohem Pioniercharakter. Typische Beispiele dafür sind unter den dominant auftretenden Arten der Haarrandschnellläufer (Harpalus affinis) und der Kupferfarbene Buntgrabläufer (Poecilus cupreus). Wenn man die rezedenten Arten, die mit weniger als 1% vertreten sind, unberücksichtigt läßt, erhöht sich dieser Anteil auf der teilzeitbegrünten Fläche auf 78%, während er auf der ganzjährig begrünten Magerrasenfläche gleich bleibt.
Daneben treten aber auch thermophile Arten auf, die an natürliche Trockenstandorte wie Trockenrasen, Trockenhänge, Kalktriften oder Steppenheiden gebunden sind. Sie sind, da diese Habitate, anthropogen bedingt, stark abnehmen, allesamt als ökologisch wertvoll einzustufen. Dazu gehören von den häufigeren Arten der Zwergstutzläufer (Microlestes minutulus) und der auf der Vorwarnliste der Roten Liste stehende Kleine Bombardierkäfer (Brachinus explodens).
Der Anteil der thermophilen Arten natürlicher Trockenstandorte lag in der Magerrasenfläche mit 42% höher als in der teilzeitbegrünten Fläche, wo 33% der Arten diesem Habitattyp angehörten.
Während sich die Individuenzahlen auf den beiden Untersuchungsflächen kaum unterschieden und in der vielfältig begrünten Fläche sogar etwas höher lagen, wurden auf der teilzeitbegrünten Fläche etwas mehr, nämlich 20 gegenüber 15 Arten gefangen. Auch die Verteilung der Individuen auf die einzelnen Arten war an diesem Standort insgesamt gleichmäßiger und damit ökologisch günstiger:
 Zoombild vorhanden
Zoombild vorhanden
Abb 5 - Dominanzartenkurve TZ
Die Evenness lag für beide Flächen ähnlich hoch (TZ: E=0.88, DG: E=0.77). Das Artenspektrum beider Flächen zeigte eine relativ große Übereinstimmung mit 63%, und auch die Dominanzidentität lag mit eine Renkonenindex von RE=58% relativ hoch.
Wieder waren auf beiden Flächen überwiegend xerophile Arten zu finden, die mit 90% auf der bearbeiteten Fläche noch stärker vertreten waren als auf der ganzjährig begrünten Parzelle (73%). Wie an Standort I dominierten Charakterarten für Agrozönosen und typische Besiedler von Ruderalflächen mit 65% auf der teilzeitbegrünten und 40% auf der dauerbegrünten Fläche.
 Zoombild vorhanden
Zoombild vorhanden
Abb 6 - Dominanzartenkurve DG
Der Anteil thermophiler Arten natürlicher Trockenstandorte betrug in der dauerbegrünten Fläche 40% und lag damit höher als in der teilzeitbegrünten Fläche mit 30%.
Eudominante und dominante Arten am Standort I
- Poecilus cupreus
- häufige, weit verbreitete Art mit eher hygrophilen Lebensraumansprüchen
- auf lehmigen Feuchtwiesen und in Flußauen, in Lehmgruben und Ziegeleien, auf lehmigen Äckern und Ruderalflächen sowie an feuchten Waldrändern zu finden
- im Südwesten auch an Trockenhängen häufig
- Harpalus affinis
- eurytope, xerophile Art, die als Charakterart für Agrarzönosen trockener Ackerflächen gilt
- auch auf Trocken- und Halbtrockenrasen, Dünen, in Steinbrüchen, Ziegeleien und Kiesgruben sowie an Waldrändern, auf Lichtungen und in Gärten häufig zu finden
- Microlestes minutulus
- ärmeliebende Art, die an Trockenhängen, in Weinbergen, Steinbrüchen, Ziegeleien und auf trockenen Feldern häufig anzutreffen ist
- Brachinus crepitans
- Stenotope, thermophile Art mit engen Lebensraumansprüchen
- Bewohner von Kalktriften, Kalksteinbrüchen, Weinbergen, Steppenheiden und Trockenrasen
- Trechus quadristriatus
- hygrophile Art, die hauptsächlich auf lehmigen Äckern, feuchten Ruderalflächen, in Gärten und an Waldrändern vorkommt
- weit verbreitet an trockenen Standorten wie Weinbergen, auf trockenen Feldern und auf Rekultivierungsflächen
Eudominante und dominante Arten am Standort II
- Harpalus affinis
- siehe oben
- Trechus quadristriatus
- siehe oben
- Microlestes minutulus
- siehe oben
- Leistus spinibarbis
- thermophile Art
- an Wärmehängen, auf Kalktriften, in lichten, trockenen Wäldern, auf Heideflächen, in Ziegeleien und Kalksteinbrüchen
- Auchomenus dorsalis
- eurytope, xerophile Art. Lebt auf Feldern, in sonnigen Hecken und an Waldrändern, in Ziegeleien, u.a
- lebt auf Feldern, in sonnigen Hecken und an Waldrändern, in Ziegeleien, u.a
50% der Carabiden der dauerbegrünten Magerrasenfläche und 46% der teilzeitbegrünten Fläche waren typische Bewohner periodisch gestörter Agrarflächen oder Ruderalflächen mit hohem Besiedelungsvermögen. Wenn man die rezedenten Arten unberücksichtigt läßt, erhöht sich dieser Anteil in der teilzeitbegrünten Fläche auf 78%, während er in der Magerrasenfläche gleich bleibt.
Der Anteil flugfähiger Arten lag in beiden Flächen sehr hoch mit 100% in der dauerbegrünten und 96% in der teilzeitbegrünten Fläche.
Der Anteil an Frühjahrsbrütern war ebenfalls sehr hoch (TZ:89%, DG:92%).
Betrachtet man die rezedenten Arten (<1%) der teilzeitbegrünten Fläche (n=18), so fällt auf, daß hier der Anteil der Kulturfolger mit 28% weit geringer lag, während thermophile Arten natürlicher Trockenstandorte (39%) und Arten mit hygrophilen Ansprüchen (33%) wesentlich stärker vertreten waren. Insgesamt lag der Anteil thermophiler Arten natürlicher Trockenstandorte in der teilzeitbegrünten Fläche bei 33%, während 42% aller Arten der dauerbegrünten Fläche diesem Habitattyp angehörten. Auch hier kamen, wenn auch nur als rezedente Arten, der Kleine Bombardierkäfer (Brachinus explodens) und der Blaue Buntgrabläufer (Leistus spinibarbis) vor die auf der bayrischen Rote Liste stehen.
40% aller (bzw. 60% der häufigeren) Arten der dauerbegrünten Fläche und 65% aller sowie der häufigeren Arten der teilzeitbegrünten Fläche sind Charakterarten von Agrarzönosen oder typische Besiedler von Ruderalflächen. Entsprechend hoch ist der Anteil flugfähiger Arten in beiden Flächen (100% TZ; 93% DG).
Daneben traten auch thermophile Arten natürlicher Trockenstandorte auf (30% TZ; 40% DG), darunter zwei Arten der bayrischen Roten Liste: der Kleine Bombardierkäfer (Brachinus explodens), der mit 5% noch zu den häufigeren Arten der teilzeitbegrünten Fläche gehört, und die vierthäufigste Art der artenreich begrünten Fläche: Leistus spinibarbis, der Blaue Bartläufer, der in Bayern seit 1900 als ausgestorben galt. Das stärkere Vorkommen dieser Art in der dauerbegrünten Fläche dürfte zumindest teilweise darin begründet sein, dass hier eine wesentlich höhere Collembolendichte herrschte als in der teilzeitbegrünten Fläche. Leistus spinibarbis ist mit seiner speziellen Fangmaske auf Collembolenfang spezialisiert.
Der Anteil der im Frühjahr auftretenden Arten dominierte in beiden Flächen (TZ: 70%, DG: 73%).
Die beiden Weinbergslagen zeigen grundsätzlich eine ähnliche Hangneigung und vergleichbare Niederschlagsmengen, so dass in den teilzeitbegrünten Parzellen ähnliche abiotische Standortverhältnisse herrschen und Unterschiede in den ökologischen Ansprüchen der Arten vor allem zwischen den dauer- und teilzeitbegrünten Flächen zu finden sein sollten.
Interessanterweise gab es kaum Unterschiede in den grundsätzlichen Habitatansprüchen der Arten der verschiedenen Untersuchungsflächen, was sich auch in den relativ hohen Artenübereinstimmungsindices von über 55% an beiden Standorten widerspiegelt: unabhängig vom Standort oder der Bodenbearbeitung überwogen xerophile und weit verbreitete, eurytope, macroptere Arten mit hohem Pioniercharakter, die größtenteils als typische Kulturfolger gelten und entsprechend gut an periodisch gestörte Habitate, wie sie Felder oder auch konventionell bewirtschaftete Weinberge darstellen, angepaßt sind.
Typische Vetreter hierfür mit teilweise etwas unterschiedlichen Feuchtigkeitsansprüchen sind die folgenden dominant auftretenden Arten: der Haarrandschnelläufer (Harpalus affinis), der Kupferfarbene Buntgrabläufer (Poecilus cupreus), der Gewöhnliche Flinkläufer (Trechus quadristriatus) und der Bunte Enghalsläufer (Auchomenus dorsalis).
Daneben traten als einzig weitere ins Gewicht fallende Gruppe thermophile Arten auf, die an natürlichen Trockenstandorten wie auf Trockenrasen, Trockenhängen, Kalktriften oder Steppenheiden zu finden sind. Dazu zählen von den häufigeren Arten der Zwergstutzläufer (Microlestes minutulus), der Kleine Bombardierkäfer (Brachinus explodens) und der Blaue Bartläufer (Leistus spinibarbis.
Aus Naturschutzsicht sind zwei dieser Arten von besonderem Interesse (siehe bayerische Rote Liste): der Kleine Bombardierkäfer, der in der teilzeitbegrünten Fläche am Standort I eine der dominanten Arten darstellt, wird als stark rückläufige Art mit stenotoper Biotopbindung an natürliche, thermophile Trockenstandorte beschrieben.
Der Blaue Bartläufer, eine dominante Art in der dauerbegrünten Fläche am Standort II, galt in Bayern seit 1900 als ausgestorben. Diese Art hat sehr ähnliche Ansprüche wie Brachinus explodens und breitet sich anscheinend wieder aus. Sie wurde neben den Untersuchungsstandorten in den letzten Jahren auch in einer benachbarten Weinbaugemeinde nachgewiesen (Armin Götzke, mündl. Mittlg.).
Durch den starken Rückgang natürlicher Trockenstandorte handelt es sich bei dieser Artengruppe insgesamt um wichtige, naturschutzrelevante Arten. Nur Langzeituntersuchungen können klären, inwieweit es sich bei den rezedent vertretenen Arten (vor allem auf der teilzeitbegrünten Fläche an Standort I) um „Irrgäste“ handelt, die in die Weinberge verdriftet werden oder sie zu durchqueren versuchen, sie aber nicht als Lebensraum nutzen. Oder ob es sich um Arten handelt, die dort leben und sich fortpflanzen, ohne hohe Dichten zu erreichen. Dann wird sich auch zeigen, in welchem Umfang Weinberge unterschiedlicher Bewirtschaftung als Ersatzbiotope für bestimmte thermophile Arten natürlicher Trockenstandorte dienen können.
| Standort I | Standort II | ||||
| DG:TZ (n) | DG:TZ | DG:TZ (n) | DG:TZ | ||
| Poecilus cupreus | 6 : 285 | 1 : 48 | Harpalus affinis | 25 : 33 | 1 : 1.3 |
| Harpalus affinis | 111 : 56 | 2 : 1 | Trechus quadristriatus | 29 : 9 | 3.2 : 1.0 |
| Microlestes minutulus | 16 : 82 | 1 : 5 | Microlestes minutulus | 26 : 10 | 2.6 : 1.0 |
| Brachinus crepitans | 0 : 59 | Leistus spinibarbis | 14 : 3 | 4.6 : 1.0 | |
| Trechus quadristriatus | 1 : 54 | 1 : 54 | Auchomenus dorsalis | 5 : 9 | 1 : 1.8 |
Ein weiterer Befund legt nahe, dass nicht nur die Begrünung per se, sondern auch die Art der Begrünung eine wesentliche Rolle spielt: auf dauerbegrünten Flächen sollten Samen fressende Arten der Gattungen Amara und Harpalus begünstigt werden. Tatsächlich ergibt sich folgendes Bild:
Die Verhältnisse bleiben unverändert, wenn man nur die nicht-rezedenten Arten berücksichtigt. Anders als erwartet lag am Standort II der Anteil Samen fressender Arten in der durchgängig begrünten Fläche deutlich niedriger als in der teilzeitbegrünten Fläche. Der hohe Anteil Samen fressender Arten liegt zum einen sicher an dem späten Umbruch der Winterbegrünung in der konventionellen Fläche, zum anderen aber auch an der Begrünungsart, die im wesentlichen aus Magerrasenarten ähnlich wie in der dauerbegrünten Fläche des Standort I bestand. Diese dürften längst gefruchtet haben, während sich die Kräutermischung noch in der Wachstumsphase befand.
Neben Einflüssen der Bewirtschaftung scheinen aber auch reine Standortfaktoren eine Rolle zu spielen. So war beispielsweise der Kupferfarbene Buntgrabläufer (Poecilus cupreus), der offensichtlich offene Weinbergsflächen bevorzugt, auf der teilzeitbegrünten Fläche am Standort I die mit Abstand häufigste Art. Auf der dauerbegrünten Versuchsfläche war er immer noch als subdominante Art vertreten, während kein einziges Exemplar dieser Art am Standort II gefangen wurde. Um solche Unterschiede zwischen Standorten bewerten zu wollen, wäre es unbedingt notwendig, neben den unterschiedlich bewirtschafteten Untersuchungsflächen das umliegende Umfeld in die Untersuchungen miteinzubeziehen.
| Harpalus/Amara | dauerbegrünt | teilzeitbegrünt |
| Standort II | 4/15 | 10/20 |
| Standort I | 5/12 | 8/27 |
Zusammenfassende Bewertung
Bei den häufiger auftretenden hygrophilen Arten am Standort I handelte es sich um eine dominante und eine subdominante Art, am Standort II sogar um eine eudominante neben drei subdominanten Arten. Die an dem einen Standort dominant, an dem anderen eudominant, auftretende Art war in beiden Fällen der Gewöhnliche Flinkläufer (Trechus quadristriatus), eine allgemein weit verbreitete, häufige Art, die hauptsächlich auf lehmigen Äckern, feuchten Ruderalflächen, in Gärten und Hecken, aber auch an Waldrändern, sonnigen Ufern und auf Dünen zu finden ist. Dass diese eurytope Art noch ein wesentlich breiteres Verbreitungsspektrum hat, das auch xerotherme Standorte mit einschließt, zeigt, dass der Gewöhnliche Flinkläufer regelmäßig als eudominante oder dominante Art in verschiedenen Weinbergsgebieten anzutreffen ist, desweiteren auf trockenen Ackerflächen und auf Braunkohle-Rekultivierungsflächen vorkommt. Diese Art scheint keine spezifischen Ansprüche an Feuchtebedingungen im Lebensraum zu stellen. Zusammenfassend läßt sich sagen, dass an beiden Standorten lediglich Arten mit hygrophilen Ansprüchen auftraten, die in wenigen Individuenzahlen oder als Einzeltiere gefangen wurden.
Auffällig ist, dass es sich bei fast allen Arten (mit Ausnahme von Carabus coriaceus (Lederlaufkäfer) und Leistus ferrugineus) um macroptere, also flugfähige Arten handelt, die neue oder periodisch gestörte Habitate relativ schnell (wieder-)besiedeln können. Ein Großteil der Arten hat sein Hauptvorkommen in entsprechenden Habitaten, nämlich auf Agrar- bzw. Ruderalflächen (S I: 54 %, S II: 63 %) und kann als Pionierarten eingestuft werden. Dieser Anteil erhöht sich am Standort I auf 64%, wenn man die selteneren, rezedenten Arten unberücksichtigt läßt, während er sich am Standort II kaum verändert (65%).
Für offenere, warme Flächen typisch überwogen Arten, die sich im Frühjahr fortpflanzen mit 82% am Standort I und 75% am Standort II (Tab.3+4 im Anhang). Nur auf die häufigeren Arten bezogen waren 100% am Standort I und 71% am Standort II sogenannte Frühjahrsbrüter. Mit Ausnahme eines einzelnen Lederlaufkäfers fehlen große Carabidenarten vollständig, und es dominierten die Arten kleinerer bis mittlerer Körpergröße.
Entsprechendes gilt für unterschiedlich begrünte Flächen: ein dichter Bodenbewuchs stellt für laufaktive Tiere wie Carabiden einen hohen Raumwiderstand dar und schränkt sie in ihrer Laufgeschwindigkeit, möglicherweise auch in ihrem Aktionsradius ein. Beides wirkt sich negativ auf die Aktivitätsdichte und damit die Fangzahlen der Tiere auf dauerbegrünten Flächen aus. Das bedeutet aber nicht automatisch, dass eine begrünte Fläche ein schlechteres Habitat sein muss und weniger Arten oder Tiere beherbergt. Hier kann im Gegenteil das Nahrungsangebot für Räuber attraktiver, also höher und vielfältiger sein.
Eigene Ergebnisse aus anderen Tiergruppen zeigen dies deutlich, wobei hier die Art der Begrünung eine wesentliche Rolle spielt: die Fangzahlen lagen in der vielfältig blühenden Dauerbegrünung deutlich höher als in der teilzeitbegrünten Untersuchungsfläche, in der dauerbegrünten Magerrasenfläche dagegen nicht.
Wenn eine artenreich begrünte Fläche mit hohem Blütenangebot im Vergleich zu einer monotonen Grasdecke eine größere Arthropodenvielfalt und damit auch ein höheres Beuteangebot beherbergt, so sollte die artenreiche Begrünung an Standort II auch attraktiver für Räuber und damit Carabiden sein. Tatsächlich sind hier die Individuenzahlen zwischen der teilzeit- und dauerbegrünten Fläche nahezu identisch und auch die Artenzahlen wesentlich ausgewogener als an Standort I. Einschränkend muß aber gesagt werden, dass die Winterbegrünung an Standort II, die allerdings nur in jeder zweiten Rebgasse eingesät war, erst ungewöhnlich spät nach dem Abblühen der Winterwicke umgebrochen wurde und deshalb nicht völlig mit der teilzeitbegrünten Rebfläche an Standort I vergleichbar war.
Auf Grund der vorliegenden und den Ergebnissen anderer Untersuchungen scheint uns folgende naturschutzrelevante Bewertung zulässig: auch wenn es sich bei einem Großteil der gefundenen Arten um typische, weit verbreitete Kulturfolger, die man in hohen Dichten auf Äckern findet, handelt, so sind auch eine Reihe teilweise dominanter, thermophiler Arten natürlicher Trockenstandorte vertreten, die aufgrund des starken Rückgangs ihrer natürlichen Lebensräume insgesamt als potentiell schützenswert einzustufen sind. Darunter befinden sich auch zwei Arten, die auf der bayrischen Roten Liste stehen; eine der beiden galt zwischenzeitlich sogar als ausgestorben.
Diese und andere Untersuchungen legen nahe, dass Weinberge, die in niederschlagsarmen Gebieten liegen und zumindest nach den Richtlinien des integrierten Pflanzenschutzes bewirtschaftet werden, ein, wenn auch nicht unbedingt gleichwertiges, Ersatzbiotop für bestimmte Arten natürlicher Trockenstandorte darstellen können.
Unser Dank geht an Herrn Dr. Armin Götzke, der bei der Bestimmung der Carabidenarten behilflich war.
Quellen
- Beck, H.J. (1984): Faunistisch-ökologische Untersuchungen über die Folgen einer Flurbereinigung für die Bodenarthropodenfauna eines fränkischen Weinbergs, unter besonderer Berücksichtigung der Laufkäfer und Spinnen. Diplomarbeit, Würzburg.
- Brauns, C. (1994): Einfluß von Begrünungsformen auf die faunistische Vielfalt in fränkischen Weinbergen. X. Kolloquium des internat. Arbeitskreises ‘Begrünung im Weinbau’, 52-59.
- Freude,H., Harde, K.W., Lohse, G.A. (1976): Die Käfer Mitteleuropas. Band 2. Adephaga 1. Goe-cke und Evers Verlag, Krefeld.
- Heydemann, B. (1955): Carabiden der Kulturfelder als ökologische Indikatoren. Ber. 7.Wanderversammlung dt. Entomol.. S. 172-185.
- Heydemann, B. (1956): Die Biotopstruktur als Raumwiderstand und Raumfülle für die Tierwelt.Verhandlungen der deutschen Zoologischen Gesellschaft, 332-347.
- Koch, K. (1995): Die Käfer Mitteleuropas. Ökologie. Bd.7 + 8. Goecke und Evers Verlag, Krefeld.
- Mühlenberg, M. (1989): Freilandökologie. UTB, Quelle und Meyer, Heidelberg.
- Reitter, E. (1908): Fauna Germanica. Die Käfer des deutschen Reiches. Lutz Verlag, Stuttgart.
- Remund, U., Niggli, U., Boller, E.F. (1989): Faunistische und botanische Erhebungen in einem Rebberg der Ostschweiz. Einfluß der Unterwuchsbewirtschaftung auf das Ökosystem Rebberg. Landwirtschaft Schweiz, 2, 393-408
- Rückrich, K. (1991): Untersuchungen zur Populationsdynamik von Spinn- und Raubmilben und epigäischen Carabiden in einer Rheingauer Rebanlage unter dem Einfluß unterschiedlicher Bo-denbearbeitungssysteme und Pflanzenschutzmaßnahmen. Dissertation, Universität Gießen
- Schruft, G. (1984): Untersuchungen zur Bodenfauna in begrünten Rebanlagen. Die Weinwissen-schaft 39, S.403-406.
- Spence, J. R., Niemelä, J. K. (1994): Sampling carabid assemblages with pitfall traps: the madness and the method. The Canadian Entomologist 126, p.881-894.
- Thiele, H.U. (1964): Experimentelle Untersuchungen über die Ursachen der Biotopbindung bei Carabiden. Z. Morph. Ökol. Tiere 53, S. 387-452.
- Trautner, J. Geigenmüller, K. (1987): Sandlaufkäfer - Laufkäfer. Illustrierter Schlüssel zu den Ci-cindeliden und Carabiden Europas. Margraf Verlag, Aichtal.
Anhang
Dominanz-Artenlisten
| Anzahl n | % - Anteil | |
| Harpalus affinis | 111 | 68,0 |
| Microlestes minutulus | 16 | 10,0 |
| Amara aenea | 11 | 7,0 |
| Poecilus cupreus | 6 | 4,0 |
| Harpalus azureus | 5 | 3,0 |
| Amara ovata | 4 | 2,0 |
| Badister meridionalis | 4 | 2,0 |
| Harpalus distinguendus | 2 | 1,0 |
| Badister bipustulatus | 2 | 1,0 |
| Trechus quadristriatus | 1 | 0,6 |
| Brachinus explodens | 1 | 0,6 |
| Microlestes maurus | 1 | 0,6 |
| 164 |
| Anzahl n | % - Anteil | |
| Poecilus cupreus | 285 | 46,0 |
| Microlestes minutulus | 82 | 13,0 |
| Brachinus crepitans | 59 | 10,0 |
| Harpalus affinis | 56 | 9,0 |
| Trechus quadristriatus | 54 | 9,0 |
| Bembidion quadrimaculatum | 31 | 5,0 |
| Amara aenea | 11 | 2,0 |
| Harpalus distinguendus | 8 | 1,0 |
| Acupalpus meridianus | 8 | 1,0 |
| Harpalus azureus | 5 | 0,8 |
| Amara ovata | 4 | 0,6 |
| Brachinus explodens | 4 | 0,6 |
| Auchomenus dorsalis | 4 | 0,6 |
| Microlestes maurus | 3 | 0,5 |
| Badister bipustulatus | 1 | 0,2 |
| Agonum sexpunctatum | 1 | 0,2 |
| Amara apricaria | 1 | 0,2 |
| Badister meridionalis | 1 | 0,2 |
| Badister sodalis | 1 | 0,2 |
| Calathus fuscipes | 1 | 0,2 |
| Carabus coriaceus | 1 | 0,2 |
| Dromius melanocephalus | 1 | 0,2 |
| Harpalus atratus | 1 | 0,2 |
| Harpalus rubripes | 1 | 0,2 |
| Leistus spinibarbis | 1 | 0,2 |
| Bembidion lampros | 1 | 0,2 |
| Anisodactylus binotatus | 1 | 0,2 |
| Tachys bistriatus | 1 | 0,2 |
| 617 |
| Anzahl n | % - Anteil | |
| Trechus quadristriatus | 29 | 24,0 |
| Microlestes minutulus | 26 | 22,0 |
| Harpalus affinis | 25 | 21,0 |
| Leistus spinibarbis | 14 | 12,0 |
| Auchomenus dorsalis | 5 | 4,0 |
| Harpalus rufipes | 4 | 3,0 |
| Acupalpus meridianus | 4 | 3,0 |
| Leistus ferrugineus | 4 | 3,0 |
| Brachinus explodens | 3 | 3,0 |
| Harpalus azureus | 2 | 2,0 |
| Harpalus distinguendus | 1 | 0,8 |
| Microlestes maurus | 1 | 0,8 |
| Badister sodalis | 1 | 0,8 |
| Badister unipustulatus | 1 | 0,8 |
| Bembidion quadrimaculatum | 1 | 0,8 |
| 121 |
| Anzahl n | % - Anteil | |
| Harpalus affinis | 33 | 29,0 |
| Microlestes minutulus | 10 | 9,0 |
| Trechus quadristriatus | 9 | 8,0 |
| Auchomenus dorsalis | 9 | 8,0 |
| Amara familiaris | 8 | 7,0 |
| Brachinus explodens | 6 | 5,0 |
| Harpalus rufipes | 5 | 4,0 |
| Harpalus atratus | 5 | 4,0 |
| Harpalus azureus | 4 | 4,0 |
| Badister meridionalis | 4 | 4,0 |
| Harpauls puncticeps | 4 | 4,0 |
| Harpalus rubripes | 4 | 4,0 |
| Brachinus crepitans | 3 | 3,0 |
| Leistus spinibarbis | 3 | 3,0 |
| Acupalpus meridianus | 2 | 2,0 |
| Harpalus distinguendus | 2 | 2,0 |
| Harpalus tardus | 2 | 2,0 |
| Microlestes maurus | 1 | 0,8 |
| Calathus fuscipes | 1 | 0,8 |
| Amara aenea | 1 | 0,8 |
| 116 |
Zeitliches Auftreten der einzelnen Arten an beiden Standorten
| 24. Mai | 14. Juni | 29. Juni | 12. Juli | 26. Juli | 10. Aug. | 24. Aug. | 21. Sept. | 5. Okt | 19. Okt | |
| Acupalpus meridianus | ||||||||||
| Agonum sexpunctatum | ||||||||||
| Amara aenea | 2 | 5 | 2 | 2 | ||||||
| Amara apricaria | ||||||||||
| Amara ovata | 1 | 2 | 1 | |||||||
| Auchomenus dorsalis | ||||||||||
| Badister bipustulatus | ||||||||||
| Badister meridionalis | 1 | 1 | ||||||||
| Badister sodalis | 1 | 2 | 1 | |||||||
| Bembidion lampros | ||||||||||
| Bembidion quadrimaculatum | ||||||||||
| Brachinus crepitans | ||||||||||
| Brachinus explodens | ||||||||||
| Calathus fuscipes | 1 | |||||||||
| Carabus coriaceus | ||||||||||
| Dromius melanocephalus | ||||||||||
| Harpalus affinis | 14 | 36 | 18 | 18 | 16 | 1 | 1 | |||
| Harpalus atratus | 7 | |||||||||
| Harpalus azureus | 2 | 1 | 2 | |||||||
| Harpalus distinguendus | 1 | 1 | ||||||||
| Harpalus rubripes | ||||||||||
| Leistus spinibarbis | ||||||||||
| Microlestes maurus | 1 | |||||||||
| Microlestes minutulus | 7 | 7 | 1 | |||||||
| Poecilus cupreus | 1 | 1 | 1 | 1 | ||||||
| Tachys bistriatus | 3 | |||||||||
| Trechus quadristriatus | 1 |
| 24. Mai | 14. Juni | 29. Juni | 12. Juli | 26. Juli | 10. Aug. | 24. Aug. | 21. Sept. | 5.Okt. | 19. Okt. | |
| Acupalpus meridianus | 2 | 4 | 1 | 1 | ||||||
| Agonum sexpunctatum | 1 | |||||||||
| Amara aenea | ||||||||||
| Amara apricaria | 1 | |||||||||
| Amara ovata | 2 | 1 | 1 | |||||||
| Anisodactylus binotatus | 1 | |||||||||
| Auchomenus dorsalis | 3 | 1 | ||||||||
| Badister bipustulatus | 1 | |||||||||
| Badister meridionalis | 1 | |||||||||
| Badister sodalis | 1 | |||||||||
| Bembidion lampros | 1 | |||||||||
| Bembidion quadrimaculatum | 6 | 1 | 11 | 13 | ||||||
| Brachinus crepitans | 14 | 28 | 12 | 4 | 1 | |||||
| Brachinus explodens | 1 | 2 | 1 | |||||||
| Calathus fuscipes | 1 | |||||||||
| Carabus coriaceus | 1 | |||||||||
| Dromius melanocephalus | 1 | |||||||||
| Harpalus affinis | 4 | 30 | 3 | 5 | 8 | 6 | 1 | 2 | 3 | |
| Harpalus atratus | 1 | |||||||||
| Harpalus azureus | 1 | 2 | 1 | 1 | ||||||
| Harpalus distinguendus | 3 | 2 | 1 | 2 | 1 | |||||
| Harpalus rubripes | 1 | |||||||||
| Leistus spinibarbis | 1 | |||||||||
| Microlestes maurus | 2 | 1 | ||||||||
| Microlestes minutulus | 4 | 39 | 31 | 2 | 4 | 2 | ||||
| Poecilus cupreus | 149 | 99 | 30 | 2 | 3 | 1 | 1 | |||
| Tachys bistriatus | 1 | |||||||||
| Trechus quadristriatus | 1 | 5 | 30 | 12 | 6 |
| 28. Mai | 15. Juni | 29. Juni | 13. Juli | 27. Juli | 10. Aug. | 7. Sept. | 21. Sept. | 5. Okt. | 19. Okt. | |
| Acupalpus meridianus | 2 | 1 | 1 | |||||||
| Amara familiaris | ||||||||||
| Auchomenus dorsalis | 3 | 2 | ||||||||
| Badister meridionalis | ||||||||||
| Badister sodalis | 1 | |||||||||
| Badister unipustulatus | 1 | |||||||||
| Bembidion quadrimaculatum | 1 | |||||||||
| Brachinus crepitans | ||||||||||
| Brachinus explodens | 2 | 1 | ||||||||
| Calathus fuscipes | ||||||||||
| Harpalus affinis | 2 | 5 | 5 | 6 | 3 | 4 | ||||
| Harpalus atratus | ||||||||||
| Harpalus azureus | 1 | 1 | ||||||||
| Harpalus distinguendus | 1 | |||||||||
| Harpalus puncticeps | 4 | 4 | 2 | |||||||
| Harpalus rubripes | ||||||||||
| Harpalus rufipes | 1 | 3 | ||||||||
| Harpalus tardus | ||||||||||
| Leistus ferrugineus | 2 | 2 | 1 | |||||||
| Leistus spinibarbis | 1 | 7 | 6 | |||||||
| Microlestes maurus | 1 | |||||||||
| Microlestes minutulus | 1 | 6 | 2 | 2 | ||||||
| Trechus quadristriatus | 2 | 11 | 11 | 5 |
| 28. Mai | 15. Juni | 29. Juni | 13. Juli | 27. Juli | 10. Aug. | 7. Sept. | 21. Sept. | 5. Okt. | 19.Okt. | |
| Acupalpus meridianus | 1 | 1 | ||||||||
| Amara aenea | 1 | |||||||||
| Amara familiaris | 3 | 1 | 1 | 3 | ||||||
| Auchomenus dorsalis | 1 | 2 | 6 | |||||||
| Badister meridionalis | 1 | 2 | 1 | |||||||
| Badister sodalis | ||||||||||
| Badister unipustulatus | ||||||||||
| Bembidion quadrimaculatum | ||||||||||
| Brachinus crepitans | 2 | 1 | ||||||||
| Brachinus explodens | 3 | 3 | ||||||||
| Calathus fuscipes | 1 | |||||||||
| Harpalus affinis | 1 | 8 | 10 | 8 | 5 | 1 | ||||
| Harpalus atratus | 2 | 3 | 4 | 2 | ||||||
| Harpalus azureus | 1 | 2 | 1 | |||||||
| Harpalus distinguendus | 1 | 1 | ||||||||
| Harpalus puncticeps | ||||||||||
| Harpalus rubripes | 1 | 2 | 2 | |||||||
| Harpalus rufipes | 1 | 1 | 3 | |||||||
| Harpalus tardus | 1 | 1 | 1 | |||||||
| Leistus ferrugineus | ||||||||||
| Leistus spinibarbis | 3 | |||||||||
| Microlestes maurus | 1 | |||||||||
| Microlestes minutulus | 2 | 4 | 1 | 2 | 1 | |||||
| Trechus quadristriatus | 1 | 8 |
Die Daten für diese Untersuchung wurden im Jahre 1993 von Dipl. Biol. Christiane Brauns erhoben und 1998/99 von Frau Dipl. Biol. Susanne Böll ausgewertet.
Projektinformation
Projektleitung: J. V. Herrmann
Projektbearbeiterin: Datenerhebung Dipl. Biol. Christiane Brauns (LWG-W3); Datenauswertung Dipl. Biol. Susanne Böll (LWG-W3)
Laufzeit: 01.03.1993 - 31.10.1993 und (1.5.1998-31.10.1999)
Finanzierung: nicht bekannt
Förderkennzeichen: -



